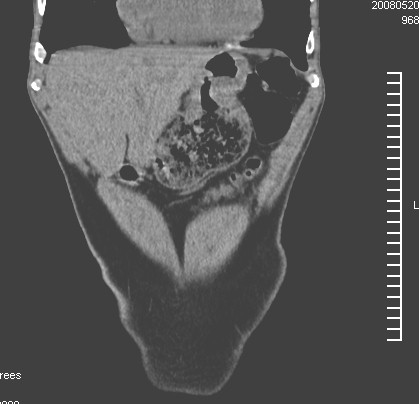
El estudio histológico demostró una lesión compatible con adenocarcinoma infiltrante moderadamente indiferenciado de células escamosas y extensas áreas de hemorragia intersticial.
Figura 1.
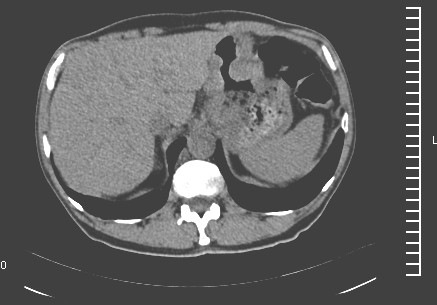
Figura 2
Discusión:
El Adenocarcinoma es el tumor clínicamente más frecuente en el estómago. Más frecuente en varones (2/1); más de las tres cuartas partes de los pacientes son mayores de 50 años, predominantemente en la séptima década de la vida. Puede originarse en cualquier zona del estómago; sin embargo, es más frecuente en el tercio antral y en la curvatura menor. El más frecuente es el adenoma (80%) y linfoma (15%)(1,2).
PRINCIPALES LESIONES PROLIFERATIVAS PRIMARIAS DEL ESTÓMAGO
Pólipos no neoplásicos: pólipo hiperplástico
Tumores benignos: adenoma, leiomioma
Tumores malignos: carcinoma, linfoma, leiomiosarcoma
Dieta (factores favorecedores)
1. Alta ingesta de proteínas, grasas animales y carbohidratos con residuos no digeribles.
2. Baja ingesta de fruta y verduras.
3. Alto consumo de sal, nitratos y nitritos.
4. Otros: Alcohol y tabaco. Actividad laboral (mayor riesgo en mineros del carbón).
Factores endógenos
1. Edad, sexo, herencia: Mayor frecuencia en varones. Mayor frecuencia entre los 50-70 años. Mayor frecuencia en ciertas familias.
2. Anemia perniciosa.
3. Gastritis crónica: (aquilia gástrica - metaplasia intestinal - 10% desarrollan cáncer); es el agente más importante en el desarrollo del cáncer gástrico.
4. Pólipos gástricos: mayor frecuencia en los adenomatoso-vellosos.
5. Úlcera gástrica: más que precanceroso sería un cáncer ulcerado desde el principio.
6. Cáncer de boca anastomótica: sobre todo en Billroth II; se involucra la nitrasación de los ácidos biliares por el reflujo biliar.
7. Grupo sanguíneo A.
8. Gastritis hipertrófica.
El Adenocarcinoma es el tumor clínicamente más frecuente en el estómago. Más frecuente en varones (2/1); más de las tres cuartas partes de los pacientes son mayores de 50 años, predominantemente en la séptima década de la vida. Puede originarse en cualquier zona del estómago; sin embargo, es más frecuente en el tercio antral y en la curvatura menor. El más frecuente es el adenoma (80%) y linfoma (15%)(1,2).
PRINCIPALES LESIONES PROLIFERATIVAS PRIMARIAS DEL ESTÓMAGO
Pólipos no neoplásicos: pólipo hiperplástico
Tumores benignos: adenoma, leiomioma
Tumores malignos: carcinoma, linfoma, leiomiosarcoma
Dieta (factores favorecedores)
1. Alta ingesta de proteínas, grasas animales y carbohidratos con residuos no digeribles.
2. Baja ingesta de fruta y verduras.
3. Alto consumo de sal, nitratos y nitritos.
4. Otros: Alcohol y tabaco. Actividad laboral (mayor riesgo en mineros del carbón).
Factores endógenos
1. Edad, sexo, herencia: Mayor frecuencia en varones. Mayor frecuencia entre los 50-70 años. Mayor frecuencia en ciertas familias.
2. Anemia perniciosa.
3. Gastritis crónica: (aquilia gástrica - metaplasia intestinal - 10% desarrollan cáncer); es el agente más importante en el desarrollo del cáncer gástrico.
4. Pólipos gástricos: mayor frecuencia en los adenomatoso-vellosos.
5. Úlcera gástrica: más que precanceroso sería un cáncer ulcerado desde el principio.
6. Cáncer de boca anastomótica: sobre todo en Billroth II; se involucra la nitrasación de los ácidos biliares por el reflujo biliar.
7. Grupo sanguíneo A.
8. Gastritis hipertrófica.
Clínica
A) Cáncer gástrico precoz: Permanece limitado a la mucosa y/o submucosa independientemente de su extensión en superficie y la presencia o no de metástasis ganglionares. La supervivencia a los 5 años es del 90-95%. El síntoma más frecuente es el dolor abdominal (epigastralgia o bién síndrome ulceroso), náuseas, vómitos, síndrome paraneoplásico, hemorragia digestiva y disfagia.
A) Cáncer gástrico precoz: Permanece limitado a la mucosa y/o submucosa independientemente de su extensión en superficie y la presencia o no de metástasis ganglionares. La supervivencia a los 5 años es del 90-95%. El síntoma más frecuente es el dolor abdominal (epigastralgia o bién síndrome ulceroso), náuseas, vómitos, síndrome paraneoplásico, hemorragia digestiva y disfagia.
B.- Cáncer gástrico avanzado: 1. No hay sintomatología específica. 2. En un 25%, dispepsia ulcerosa con dolor postprandial que cede con la ingesta o alcalinos. Hay mayor intensidad de los síntomas cuando el tumor asienta en cuerpo y curvadura menor que cuando se localiza en curvadura mayor. 3. Anorexia y repugnancia alimentaria (carne) -> signo tardío. 4. Pérdida de peso, astenia, vómitos y cambios del hábito intestinal. 5. Síndrome anémico (puede ser micro, normo o macrocítica). 6. Síndrome obstructivo: si asienta en píloro o cardias. 7. Palpación de tumor, perforación libre, fístula gastrocólica. 8. Metástasis. 9. Síndrome paraneoplásico: Síndrome nefrótico, tromboflebitis (signo de Trousseau), Acantosis nigricans, dermatomiositis, queratitis pruriginosa aguda (signo de Leser-Trelat). DISEMINACIÓN: Invasión directa a través de la pared gástrica con extensión a vísceras adyacentes. Diseminación linfática: Ganglio de Virchow (supraclavicular izquierdo, signo de Troisier). Ganglio de Irish (axilar anterior izquierdo). Diseminación transcelómica a través del peritoneo provoca ascitis maligna. Diseminación hematógena a pulmón, hígado, infiltración tumoral del ovario (Tumor de Krükemberg). Metástasis periumbilicales (nódulos de la hermana María José), Signo del anillo de Blamer (crecimiento tumoral en el Douglas). Diagnóstico Radiológico: Si bien en la actualidad el método de mayor valor en el diagnóstico del CG es la endoscopia con toma de biopsia, la radiología continúa siendo ampliamente utilizada. Los estudios radiológicos convencionales sólo detectan, generalmente, formas de cáncer avanzado o relativamente avanzado. Con el método del doble contraste pueden verse, en ocasiones, lesiones más pequeñas y que, a posteriori, podrían corresponderse a un carcinoma gástrico precoz (2,3,4,5). La tomografía computarizada (TC) es útil para la detección de metástasis a distancia y para la evaluación de los ganglios linfáticos regionales. La TC torácica se indica para la detección de metástasis pulmonares y en los tumores de localización cardial (6,7,8,9). La ultrasonografía endoscópica (USE) es superior a la TC para la estadificación local del cáncer gástrico, ya que permite distinguir las diferentes capas que conforman la pared gástrica, lo que la convierte en la mejor modalidad de imagen para determinar la profundidad de la invasión tumoral. Además, su capacidad para la detección de los ganglios perigástricos. Otra ventaja de esta técnica es que permite la punción aspirativa con aguja fina, con lo que puede obtenerse la confirmación citológica de adenopatías metastásicas y completar el estudio de lesiones submucosas (10,11,12,13). ANATOMÍA PATOLÓGICA Los más frecuentes son los adenocarcinomas. El cáncer gástrico precoz se limita a la mucosa o submucosa gástrica. En el cáncer in situ las células neoplásicas no rebasan la membrana basal y, por tanto, no infiltran. En ambos casos, la supervivencia a los 5 años tras la resección es del 90% aún cuando existan metástasis ganglionares. Su evolución, en caso de no ser tratados, es hacia el cáncer gástrico avanzado (14,15,16,17). BIBLIOGRAFÍA 1. Parkin DM. Estimates of the world wide incidence of 25 major cancers in 1990. Int J Cancer. 1999;80:827- 841. 2. Tajima K. Cancer mortality and morbidity statistics, Japan and the world. Japan Scientific Society Press. Tokyo. 2004;35:176-177. 3. Minister’s Secretariat, Statistics and Information Department Vital Statistics of Japan. Ministry of Health Labour and Welfare of Japan. Tokio. 2002;3:384-385. 4. Lizarzabal M. La Gastroenterología en Venezuela durante el primer quinquenio del siglo XXI. Revisión de Anuarios Oficiales de Mortalidad. Congreso de Gastroenterología. Caracas, 2006. 5. IARS Working Group on the Evaluation of Carcinogenic Risk to Humans. Helicobacter Pylori. En: Schistosomes, liver flukes, and Helicobacter pylori. IARC, Lyon. 1994.p.177-241. 6. Correa P. Helicobacter Pylori and gastric cancer: Stat of the art. Cancer Epidemiol Biomarkyrs Prev. 1996;5:477-481. 7. Tatematsu M. History of Gastric Carcinoma Research in Japan: Basic aspects. The diversity of gastric carcinoma. Springer Verlag, Tokyo. 2005.p.3-28. 8. Labenz J. Curing Helicobacter Pylori infection in patients with duodenal ulcers may provoke reflux esophagitis. Gastroenterology. 1997;112:1442-1447. 9. Tsugane S. Salt and salted foot intake and subsequent risk of gastric cancer among middle aged Japanese men and women. Br J Cancer. 2004;90:128-134. 10. Yoshída S. Endoscopic diagnosis: Latest trends. Gastric cancer. Springer, Tokyo. 1993.p.246-262. 11. Maruyama K. Surgical treatment and end result of gastric cancer. National Cancer Center Press, Tokyo. 1985:27. 12. Tasaka T. National questionnaire of gastric cancer in Japan. Gastroenterol Endosc. 1962;4:4-14. 13. Borrmann R. Geschwulste des Magens und Duodenums. Springers, Berlin. 1926;4:812-1054. 14. Okumura T, Maruyama M. A prospective study of advanced gastric cancer detection by mass screening. Gastric cancer. Springer Verlag, Tokyo. 1993:263-337. 15. Iinuma G. Diagnosis of gastric cancers: Comparison of conventional radiography with a 4 million - pixels charge-coupled device. Radiology. 2001;214:497-502. 16. The Paris endoscopic classification of superficial neoplasic lesions: Esophagus, stomach and colon: November 30 to December 1, 2002. Gastrointes Endosc. 2003;6:34-42. 17. Japanese Gastric Cancer Association. Gastric cancer treatment guidelines. 2ª edición. Kamehara Tokyo. 2004. |
No hay comentarios:
Publicar un comentario